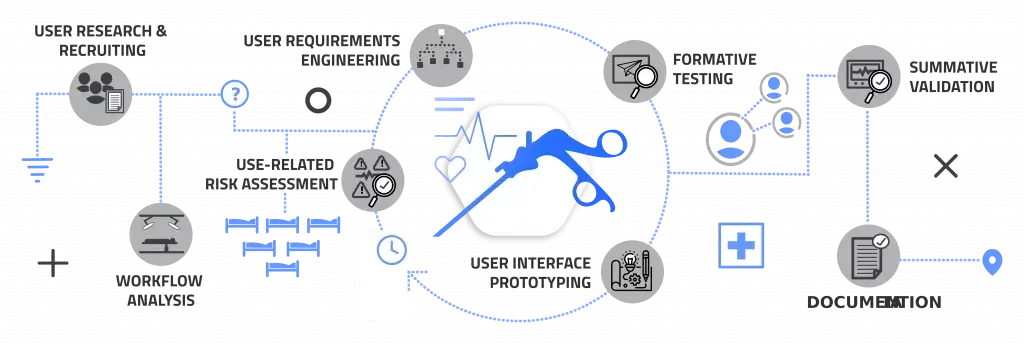
Sicherere Medizinprodukte entwickeln durch ein systematisches Usability-Engineering-Verfahren.
Wie man IEC 62366-1 erfolgreich anwendet: praktische Strategien zur Beschleunigung der Zulassung, Minimierung von Anwendungsfehlern und Erhöhung der Patientensicherheit.
Warum das wichtig ist
Beginnen Sie damit, Ihren Usability-Engineering-Prozess für Medizinprodukte zu stärken.

Certified Medical Devices Usability Expert (TÜV)
UXQB® Certified Professional for Usability and User Experience (CPUX-F)
Eine Analyse des medizintechnischen Nutzungskontextes (Context of Use Analysis) stellt den ersten Schritt des nutzerzentrierten Entwicklungsprozesses dar. Das Ziel: Eine Use Specification, welche zukünftige Benutzer (User), deren Aufgaben, Arbeitsabläufe (Tasks) sowie die Arbeitsumgebungen (Use Environments) systematisch und umfassend erfasst. In Übereinstimmung mit normativen Anforderungen, der IEC 62366-1 und weiteren Normen setzen wir zur Datenerhebung geeignete Methoden ein:
Je nach Projektanforderungen wählen wir das geeignete Verfahren. Durch Protokolle, Audio- und Videoaufzeichnungen bis hin zu fortschrittlichen Analysetools wie Eye-Tracking und Motion-Tracking erheben wir dabei alle relevanten qualitativen und quantitativen Daten. In der anschließenden Anforderungsanalyse leiten unsere Experten die relevanten User Requirements und User Needs.
Möchten Sie Ihre Benutzer wirklich verstehen und somit echten Nutzen schaffen?
Wir unterstützen Sie dabei.
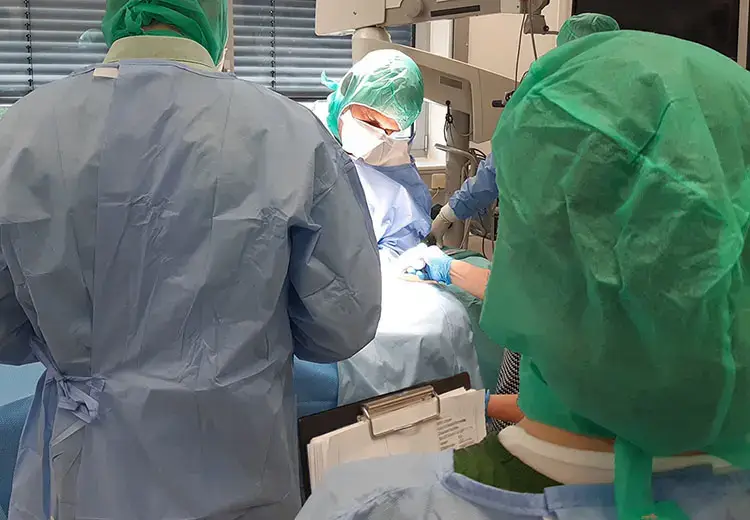

Wir helfen Ihnen bei der Analyse und Minimierung potenzieller Risiken der Produktnutzung. Die ISO 14971 verpflichtet im Rahmen der Entwicklung von Medizinprodukten dazu. Unsere Experten berücksichtigen dabei interaktions- und nutzungsbedingte Risiken (Use-related Risks) sowie gefährliche Situationen (Hazardous Situations) und definieren anwendungsbezogene Gefahrenszenarien (Hazard-related Use Scenarios) für Sie. Um diese kritische Usability-Engineering-Phase erfolgreich abzuschließen, unterstützen wir Sie daher mit:
Unsere Erfahrung bei Planung, Durchführung und Auswertung erleichtert dabei die Integration in die technische Risikobewertung.
Wollen Sie zuverlässig eine sichere Anwendung Ihres Medizinprodukts gewährleisten?
Wir kümmern uns darum.
Im Rahmen der Spezifikation werden die in der Analyse erhobenen Informationen gebündelt. Dies geschieht auf Anforderungsebene durch die Ableitung von Nutzungsanforderungen und User Interface Requirements, die in Form eines Lasten- und Pflichtenhefts gebündelt und spezifiziert werden können. Anhand von Workflow-Analysen werden Aufgabenmodelle (Tasks) erarbeitet und in regulatorisch notwendige Nutzungsszenarien (Use Scenarios) transferiert. Aber auch die Erarbeitung eines regulatorisch relevanten Nutzungsspezifikationsdokuments (Use Specification) lässt sich hierunter fassen. Das Resultat: Stärken und Schwächen des Medizinproduktes und des Workflows werden sichtbar und können durch intelligente Produktgestaltung optimiert werden.
Sie fragen sich, wie sich die Lücke zwischen qualitativer Forschung und technischer Spezifikation schließen lässt?
Unsere Experten unterstützen Sie bei der Entwicklung Ihrer Anforderungsspezifikation.

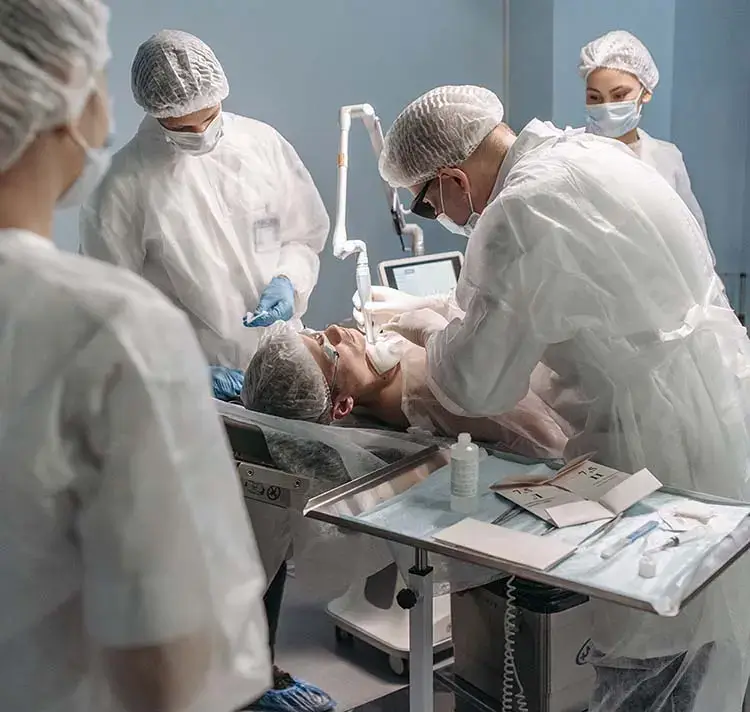
Sowohl die FDA Guideline als auch die IEC 62366-1 sehen die Absicherung der Usability, sowohl entwicklungsbegleitend (formativ) als auch entwicklungsabschließend (summativ), durch den gezielten Einsatz von Usability Evaluationsmethoden vor. Unsere Experten führen sowohl expertenbasierte Inspektionsmethoden, wie den Cognitive Walkthrough oder Heuristische Evaluationen, als auch Usability Tests mit Probanden durch oder unterstützen Sie bei den Ihrigen. Die Rekrutierung repräsentativer Testnutzer stellt dabei einen wichtigen und regulatorisch verpflichtenden Faktor dar. Mit unserem Probandenpool von über 3000 medizinischen Fachkräften sind wir in der Lage, jede medizinische Fachdisziplin abzubilden und für Tests zu rekrutieren. Die normgerechte Auswertung und verständliche Aufbereitung der Studienergebnisse gehören selbstverständlich ebenso zu unserem Repertoire.
Sie möchten die Gebrauchstauglichkeit Ihrer Medizinprodukte vor Inverkehrbringung mit medizinischen Fachanwendern testen?
Wir freuen uns darauf, Sie zu unterstützen.

Das interaktive Online-Training für Fachkräfte mit Schwerpunkt auf dem regulatorischen Human-Factors- und Usability-Engineering-Prozess für Medizinprodukte. Mit der Möglichkeit, das CPUX-F-Zertifikat zu erwerben.
